fluorF's Laboratory
웹사이트 소개
Introduction of the website
fluorF 소개
Introduction of fluorF
새로운 소식
News
하루 이야기
Daily essay
글
Articles
사진첩
Album
방명록
Guestbook
글
Articles
미술 1
Fine Art 1
유화와 화학
물감과 분산액
Paints and Dispersions
본 시리즈는 2016년 8월 3일부터 5일까지 신성고등학교에서 3일간 진행했던 창의융합과정 수업(교양과학)에서 사용된 강의 자료를 바탕으로 만들어졌다. 2016년 8월의 강의는 내가 신성고등학교에서 진행한 세 번째 강의였는데, 지난 강의였던 '음악과 물리학'이 그 전 강의인 '과학과 철학'보다 학생들에게 더 흥미로운 주제였던 모양인지 훨씬 반응이 좋았다. 그래서 이번에도 예술쪽의 내용을 과학과 결합시킨 내용으로 강의를 진행하고자 했다.
그런데 명색이 대학원 전공이 화학인데 직전 두 강의에서는 물리학 얘기만 하고 있었으니 왠지 내 주전공도 아닌 것을 가지고 이런저런 논한다는 것이 약간 부끄럽게 느껴졌다. 그래서 가장 '화학적'인 이야기를 할 수 있는 예술 분야는 바로 미술이기에 미술과 화학을 엮어 학생들에게 설명해 주기로 결심했다. 사실 공부를 조금 한 학생들은 ― 특히 선행학습으로 물리학을 먼저 배운 학생들의 경우 ― 음악이 물리학적 현상과 관련이 있다는 사실을 자세히는 모르더라도 어느 정도 들어 알고 있긴 했었다. 그러나 미술이 화학적인 현상과 직접적으로 어떻게 연결되는지에 대해서는 학생들이 거의 대부분 몰랐기 때문에 학생들은 대부분 지난 강의보다 이번 강의가 더 신기했다고 느끼는 것 같았다. 나 스스로도 강의 준비를 하면서 화학을 좀 더 자세히 이해하는 경험을 했고, 보다 즐겁게 강의 자료를 만들 수 있었다. 그리고 당연한 이야기지만 내겐 화학을 설명하는 것이 물리학 내용을 설명하는 것보다 훨씬 수월했다.
본격적인 시작에 앞서, 강의 자료 첫 슬라이드에 써 두었던 강의 개요를 아래에 옮긴다.
본 강좌는 서양 회화(繪畵)의 주요한 형태인 유화(油畵)를 화학적 관점에서 이해하는 것을 목표로 한다. 유화에 사용된 물감의 구성 성분의 화학적 특성을 고찰함으로써 유화가 가진 독특한 특성이 어떻게 발현되는지 이해하고, 이를 바탕으로 물질의 고유한 성질로서 색채를 물리화학적인 측면에서 이해할 수 있다.
본격적인 탐구에 앞서 아래 영상을 한번 감상(?)할 필요가 있다. 처음에는 아무것도 아니었던 캔버스가 어느 순간 갑자기 멋진 풍경으로 뒤바뀌는 것을 보고 경악을 금치 못할 것이다. 특히 침엽수가 그려지고 물에 반사된 모습이 그려질 때는 넋이 나갈 지경이다. 도대체 이런 마술을 어떻게 부린단 말인가?
위와 같은 예술활동을 우리는 회화라고 한다. 회(繪)는 그린다, 채색한다는 뜻을 가지고 있으며 화(畵)는 그렇게 해서 만들어진 그림을 의미한다. 하지만 회화에 대한 정의를 단순히 '그려진 그림'이라고 하기엔 너무 민망하다. 프랑스의 화가이자 나비파(Les Nabis)의 일원이기도 했던 모리스 드니(Maurice Denis, 1870-1943)는 회화의 정의에 대한 다음과 같은 유명한 말을 남겼다.
Remember that a painting — before being a warhorse, a naked woman or some story or other — is essentially a flat surface covered with colors assembled in a certain order
회화란 군마(軍馬)든, 여성의 누드이든, 어떤 이야기든, 뭐든지간에 본질적으로 특정한 질서에 따라 배열된 색깔로 뒤덮인 평면이라는 것이다.
국립국어원 표준국어대사전은 모리스 드니의 영향을 받았는지 회화를 '여러 가지 선이나 색채로 평면 상에 형상을 그려 내는 조형 미술'로 정의하고 있다. 이 정의에 따르면 회화의 두 가지 특징을 알 수 있는데 바로 2차원적 조형 미술이라는 점, 그리고 그 2차원 평면은 하나 이상의 색깔로 덮여 있는, 즉 칠해져 있다는 것이다. 그림이 그려지는 2차원 평면은 무척 다양한데 종이가 될 수도 있고, 콘크리트 벽이 될 수도 있으며, 나무가 될 수도 있을 것이다. 그러나 이번 편에서 우리가 우선적으로 주목하고 싶은 것은 '물감'이니까 2차원 평면에 대한 이야기는 나중으로 잠깐 미뤄두도록 하자. 우리가 우선 알아봐야 하는 것은 다음과 같다: 도대체 물감의 색깔이 어떻게 발현되어 2차원 평면에 칠해진 뒤 우리 눈에 그림으로서 보여지는가 하는 것이다. 이를 이해하기 위해서 색의 정의와 물리화학적인 원리부터 설명을 시작할 수도 있겠지만, 그런 상향식 접근은 너무 재미없을 테니까 우선 현상학적인 색깔의 발현부터 이야기해보며 논의를 확장시켜 보자.
자, 당신 앞에 하얀 도화지가 있다. 누군가가 당신더러 그림을 그려달라고 부탁했다. 무엇이 필요한가? 우선 무엇을 그릴지 그 대상을 상상하는 것이 필요할 것이고 그것을 그려낼 도구 ― 이를테면 붓이라든지 ― 가 필요할 것이다. 하지만 그 무엇보다도 더 원초적으로 필요한 것은 바로 물감이다. 물감이 없으면 하얀 도화지 위에서 아무리 상상의 나래를 펼치며 붓질을 현란하게 해 보아야 하얀 백지 그대로 남을 것이 아닌가. 물감도 없이 붓질을 하는 당신을 보고 아마 누군가는 '당신 머리가 살짝 돈 것이 아니오?'하고 비아냥거릴 지도 모른다. 결국 그림을 그리려면, 물체 표면에 색을 칠할 수 있게 만든 것을 반드시 이용해야만 하며, 이것이 바로 물감의 정의가 될 것이다.
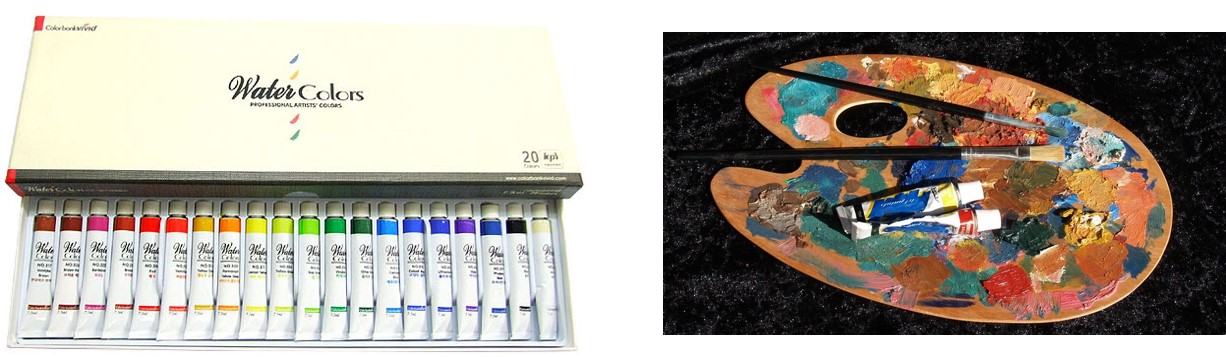
그런데 물감은 어떻게 만들어지고, 어떤 성분으로 구성되어 있을까? 우리는 짧게는 십수년, 길게는 수십년동안 물감을 구매하면서 어딘가에 직접 칠해 왔으면서도 정확하게 물감이 어떤 존재인지도 모른채 그저 찍어 바르고, 펴 바르고, 뿌리며 지내왔다. 이제 그 무지(無知)에서 벗어날 차례이다. 누군가가 당신에게 '물감의 성분은 무엇입니까?'라고 물어본다면 이제 당당하게 가슴을 펴고 물감이란 다음의 두 성분으로 이뤄져 있다고 설명해 줄 수 있어야 한다.
- 현색제(顯色劑, colorant): 색깔을 내는 재료로서 발색(發色)성분을 포함하고 있는 요소.
- 전색제(展色劑, medium/vehicle): 현색제를 물체 표면에 정착시키기 위한 요소.
- 1아마도 현재 2017년 현재 30~40대인 분들은 EBS에서 방영한 이 프로그램을 한 번이라도 본 적이 있을 것이다. 그의 명대사는 "어때요? 참 쉽죠?"였는데 문제는 전혀 쉽지 않다는 데에 있다.
- 2당류(saccharide) 물질들이 서로 결합할 때에는 헤미아세탈(hemiacetal) 혹은 헤이케탈(hemiketal) 그룹과 하이드록시(hydroxyl)기가 서로 결합하는데 산소 원자를 통해 연결된 형태를 띠고 있으며 이를 특별히 글리코사이드 결합이라 부른다.
- 3학부 전자기학 수준이면 쉽게 이해할 수 있는 내용이지만 전자기학과 거리가 먼 사람이라면 이해하기 힘든 내용일 수 있다. 우리는 중고등학교 때 이미 전기 단극자(monopole) 사이의 전기력에 대해 익힌 적이 있는데, 말이 거창해서 전기 단극자이지 전기 단극자는 곧 전하(charge)이며 전기 단극자 사이의 힘은 저 유명한 쿨롱의 법칙(Coulomb's law)으로 정의된다. 전기 쌍극자는 쉽게 말하면 양전하와 음전하가 자석의 N극과 S극처럼 서로 나란하게 배치된 묶음이라고 생각하면 되며, 자석 (=자기 쌍극자) 사이에 힘이 작용하듯 전기 쌍극자에도 힘이 작용한다.
- 4이를 열역학적으로 표현하면 반응에 따른 깁스 자유 에너지(Gibbs Free Energy) 변화가 음(-)이다. (ΔG<0)
- 5물론 이러한 화학 변화는 엄밀하게 이야기하면 깁스 자유 에너지(Gibbs free energy, ΔG) 측면에서 이해하는 것이 옳다. 즉, 상호작용 에너지에 의한 자발적 용해 현상은 엔탈피(enthalpy, ΔH) 측면에서만 이야기한 것이므로 보다 정확하게 이를 이해하려면 엔트로피(entropy, ΔS)의 변화도 고찰해야만 한다. 통계열역학적인 의미에서 엔트로피는 무질서도에 해당하는데 설탕이 물에 용해되는 것은 규칙적으로 쌓인 설탕 결정이 모두 흩어져서 물에 섞여 들어가는 것이기 때문에 무질서도는 굉장히 높아지게 된다. (이는 다음 문단에서 설명할 소금의 용해에도 동일하게 적용된다.) 따라서 용해라는 화학 변화 과정에서는 엔트로피는 항상 증가하는 방향이며 결국 물질이 잘 녹느냐 잘 안 녹느냐는 용질-용매간 상호작용에 따른 엔탈피 변화에 크게 좌우된다.
- 6물리학적으로 이야기한다면 물 분자의 유전 상수(dielectric constant)가 높아서 이런 일이 가능하다. 즉, 극성 용매라고 해서 모두 이온 결정을 녹일 수 있는 것은 아니다.
- 7http://butane.chem.uiuc.edu/pshapley/Enlist/Labs/LiquidSol/2c.png
- 8참고로 이 정도 크기의 입자들은 화학적으로 굉장히 독특한 성질을 가지며 특별히 콜로이드(colloid)라고 부른다.
- 9분산질의 크기가 커질수록 동일 질량대비 분산매와 상호작용할 수 있는 총면적 및 상호작용 에너지 크기는 줄어들 수밖에 없다.
- 10미세먼지 농도를 나타내는 용어인 PM2.5, PM10은 각각 크기가 2.5 μm, 10 μm 이하인 입자성 물질(particulate matter, PM)의 농도를 말한다. 정확하게 분산질의 크기 범위에 해당된다.
- 11고분자화학에서는 이와같이 그물형으로 연결된 고분자 구조 사이에 액체 용매가 들어가 있는 것을 팽윤(膨潤, swelling)이라고 한다.
- 12참고로 여기에 링크된 영상은 http://blog.naver.com/foblog/220667023913 의 글을 참고하여 링크하였다.
현색제는 크게 두 종류로 나뉘는데 하나는 염료고, 다른 하나는 안료이다. 우선 염료(染料, dye)란, 물이나 기름 등에 녹을 수 있는 현색제로 섬유나 종이와 같은 재료에 달라 붙어 착색이 가능한 물질을 일컫는다. 좀 더 화학적으로 이야기하면 이들 염료는 유기 단분자들이다. 가장 대표적인 염료 중 하나는 바로 2,2'-Bis(2,3-dihydro-3-oxoindolyliden)으로 아래와 같은 화학 구조식으로 표현 가능하다. 그리고 이 염료의 다른 이름은 '인디고(indigo)'이다.

인디고는 쪽과 같은 천연 식물로부터 얻을 수 있는 가루 물질로 굉장히 강한 파란색을 띠는데, 스승보다 더 나은 제자가 나온다는 청출어람(靑出於藍)이란 말이 쪽보다 더 푸른 인디고의 쪽빛에서 비롯된 말이다. 이 인디고 염료가 쓰이는 가장 보편화 된 제품 중 하나가 바로 우리 모두 옷장에 한 벌쯤은 가지고 있는 청바지가 되겠다. 전세계에서 만들어지는 청바지의 숫자만 상상해보더라도 인디고 염료가 현대 패션 산업에서 차지하는 비중이 엄청나게 크다는 것을 실감할 수 있을 것이다. 이 인디고는 물이나 알코올에는 잘 녹지 않으나 다이메틸설폭사이드(dimethylsulfoxide), 클로로폼(chloroform)과 같은 유기 용매에는 잘 녹는다.
액체에 녹일 수 있는 염료는 다루기 쉽기 때문에 옛날부터 천을 염색하는데 널리 사용되었다. 그러나 1년 전에 산 청바지 색깔이 어느새 바래진 것을 알고 있는 독자라면 염료가 가지는 치명적인 문제가 무엇인지 바로 알 수 있을 것이다. 바로 유기 단분자인 염료는 외부의 빛이나 열에 의해 분해되거나 변형되기 쉽다는 점이다. 이 때문에 염료가 회화용 현색제로서 사용되는 것은 지극히 제한적이었다. 생각해 보자. 염료로 그린 그림은 처음에는 산뜻한 색깔을 자랑할테지만, 시간이 지날수록 색이 점점 바래질 것이다. 우리는 이런 현상을 음식물이 튄 옷감에서 자주 본다. 예를 들어 실수로 포도의 보랏빛이 흰 셔츠를 물들였다고 생각해보자. 처음엔 보라색일 것이지만 (중간에 세탁을 제대로 하지 않았다는 가정 하에) 시간이 지날수록 점점 이것에 보라색인지 모를 정도로 정체모를 색깔로 바래져 갈 것이다. 회화 작품에서 이런 일이 발생한다곳 생각해보라! 심혈을 기울여 제작한 그림의 색채가 몇 달을 못 버텨내고 죄다 바래진다면 이 얼마나 땅을 치며 억울해할 일이 아니겠는가?
염료에 대한 이야기를 이쯤 해두고 이제 고개를 돌려 안료(顔料, pigment)에 대해 알아보자. 안료가 염료로부터 구별되는 가장 큰 특징은 물이나 기름 등에 절대 녹지 않는 분말 형태라는 것이다. 왜냐하면 안료는 일종의 돌가루이기 때문인데, 좀 더 화학적으로 유식하게 말해 보자면 안료라는 것은 일종의 금속 염(鹽, salt)이다. 예를 들어 흰색 안료로 사용된 화이트 레드(white lead)라는 안료의 구성식은 (PbCO3)2·Pb(OH)2으로 납의 탄산염 및 수산화염이 되겠다. 일반적으로 금속 염은 유기 단분자에 비해 빛이나 열에 의한 화학적 변화에 대체로 무심한 편이다. 즉, 안료는 내구성과 내열성, 그리고 빛에 대한 저항성 면에서 염료에 비해 훨씬 우수하여 오랫동안 본연의 색을 유지할 수 있다는 장점이 있었다.

이런 이유로 수채화든 유화든 동양화든, 회화용 현색제로는 (특수한 목적이 아니고서는) 대체로 색이 오랫동안 지속될 수 있는 안료가 사용되었다. 즉 우리가 지금까지 사용했던 물감들은 대체로 색을 띠는 돌가루가 섞여 있는 물감이었다는 뜻이다. 아래 영상은 안료를 뒤섞어 물감을 만드는 과정을 담은 것이다.
그런데 여기서부터 독자는 뭔가 이상하다는 느낌을 받을 수 있다. 아니, 물감이 용매에 안 녹는 돌가루로부터 만들어졌다고? 위 영상 마지막 부분에서도 확인할 수 있지만, 우리가 예를 들어 수채 물감을 이용해서 그림을 그린다고 한다면 우선 물감을 팔레트에 짜서 굳혀놓아야 한다. 그런 다음에 물을 묻힌 붓을 이용해서 물감을 풀어내어 팔레트 빈 공간 위에 덜어낸 뒤 적절하게 다른 색을 배합하고 물을 이용해 농담(濃淡)을 조절한다. 원하는 색채와 농도가 완성된다면 이를 붓에 다시 흠뻑 묻히고 나서 종이에 갖다대어야 한다. 그런데 안료는 물이나 기름에 녹지 않는다며? 우리가 사용하는 수채물감은 안료로 만들어진 것이기 때문에 원칙적으로 물감은 물에 녹을 수가 없는 것이다. 하지만 우리는 너무나도 능숙하게 물감들을 물에 '녹여내서' 그림을 그려오지 않았던가? 아니다! 물감은 절대 물에 녹을 수 없는 것이라고 했다. 아니 그러면 우리는 팔레트 위에서 물감이 녹는 것처럼 보이는 헛것을 본 것인가? 도대체 물에 잔잔히 퍼지는 물감 덩어리는 어떻게 설명할 것인데?

본격적으로 화학 이야기를 할 때가 왔다. '녹는다'는 것은 무엇을 말하는가?
두 가지 이상의 물질이 균일하게 혼합되어 있는 것을 용액(溶液, solution)이라고 한다. 이 때 다수를 차지하는 것을 용매(溶媒, solvent)라고 하며 용매가 아닌 것들은 모두 용질(溶質, solute)이라고 한다. 예를 들어 소금 1 g을 물 100 g에 녹인다면 물이 용매, 소금이 용질이 되며 이것은 소금 물 용액이 되는 것이다. 이 때 녹이는 현상을 한자어로 유식하게 표현하자면 용해(溶解, dissolution)라고 한다.
여기서 가장 중요한 것은 '균일하게 혼합'되어 있다는 사실이지 용액이 액체여야 한다는 것은 아니다. 한자어로 용액이라고 쓸 때 액(液)이라는 글자 때문에 용액이 무조건 액체여야 한다고 생각할 수 있으나 화학적 관점에서 서로 다른 물질이 균일하게 혼합만 되어 있다면 용액은 액체가 아니라 기체, 혹은 고체일 수도 있다. 예를 들어 금(金, Au)을 수은(水銀, Hg)에 녹일 수 있는데 이 경우 아말감(amalgam)이라는 합금(合金, alloy)이 만들어진다. 합금은 고체 용질이 고체 용매에 용해된 일종의 용액으로 생각할 수 있으며, 이 경우 (대체로) 수은이 용매 역할을 하게 된다. 그러니까 비록 한국어 표현에 한계가 있을지라도 용액이 액체여야 한다는 생각을 버리자!
다시 한번 강조하지만 용액 내에서 용매와 용질은 '균일하게 혼합'되어 있어야 한다. 균일하게 혼합된 용액의 가장 중요한 특성 중 하나는 용질 입자가 용액 내에서 맨눈으로 전혀 보이지 않는다는 것이며 용액은 투명한 색을 가진다는 것이다. 게다가 용액은 장시간 보관해도 균일함을 잃지 않는다는 특성이 있다.

이제 우리가 수채화 그리던 시절로 잠깐 시간 여행을 해 보자. 수채화를 그릴 때 챙겨야 할 준비물 중 하나는 바로 물통이었다. 아코디언처럼 접히는 물통에 처음 깨끗한 수돗물을 받아놓고 그림을 그리기 시작한다. 붓에 물감을 묻힌 뒤 스케치북에 칠하고, 이제 색깔을 바꾸려면 물통에 담가 물감을 모두 녹여 씻어낸 뒤 다른 물감을 묻히고 스케치북에 칠한다. 이 과정을 반복하면 미술 시간이 끝날 때쯤 다음 시간이 오기 전에 쉬는 시간에 물통에 든 물을 화장실에 버리고 와야 하는데 대개 이 시점에서의 물통 안의 물이 어떠했는지 다들 기억을 하는가? 각종 색깔이 섞이다보니 물통 속 물은 그야말로 '구정물(?)' 수준의 회색 물이 되어 있었지 않았나?
그런데 여기서 한 가지 생각해 볼 점: 그 물이 투명했는가? 아니 전혀, 물감을 풀어놓은 물은 굉장히 불투명한 용액이었다. 아니 가만, 용액은 균일하게 혼합된 것이라서 투명하다며? 그런데 물감을 분명 물에 녹였는데 투명하지 않은 물이 만들어진 것이면 이것은 화학적인 의미에서 용액이 아니지 않은가? 게다가 의심스러운 점은 하나 더 있다. 물감을 풀어놓은 물을 오랫동안 놔두면 물통 아랫부분에 진하게 뭔가가 가라앉은 것같은 인상을 받게 된다. 윗부분의 상대적으로 맑은 부분을 따라 버리면 굉장히 점도가 있는 것 같이 진한 구정물(?)이 모습을 드러낸다. 이게 무슨 말이냐하면 물감을 풀어놓은 물은 애초에 균일하게 혼합된 것이 아니었다는 것이다. 그렇다면 대체 이 불균일한 혼합물(heterogeneous mixture)은 무엇이란 말인가?

화학에서는 이와 같이 입자들이 용해되지는 않았음에도 다른 물질에 연속적으로 분포하는 것을 분산(分散)이라고 한다. 가만, 이렇게 정의하면 용해와 분산이라는 화학적 현상에 대한 기준이 굉장히 모호해지는 것 같다. 용해나 분산이나 다 어떤 물질이 다른 물질에 섞여 들어가 연속적으로 분포하는 것이 아닌가? 그래서 화학자들은 이런 모호한 기준을 해결하기 위해 섞여 들어가는 물질의 크기를 논하기 시작했다. 만일 물질 A가 물질 B에 섞여 들어가는데 그 섞여 들어가는 A의 크기가 (고분자를 포함해서) 분자(分子, molecule) 단위 이하라면 이것은 용해 과정이다. 이제 A와 B가 서로 만나서 뒤섞이기 전에 미시적(微視的)인 세계에서 어떤 일들이 벌어지는지 알아보자.
예를 들어 각설탕은 설탕 분자들의 거대한 집합인데 설탕 분자를 좀 더 유식한 말로 수크로스(sucrose) 혹은 자당(蔗糖)이라고 부른다. 수크로스 분자는 글루코스(glucose)와 프럭토스(fructose)가 글리코사이드 결합(glycosidic bond)2으로 결합되어 있으며 약간 극성(polar)을 띠는 물질이다. 따라서 수크로스 분자들은 자체적인 극성으로 인해 쌍극자(dipole)를 형성하는데, 이렇게 형성된 전기 쌍극자 사이에서는 서로 인력이 작용한다.3 이런 이유로 수크로스 분자들은 자기들끼리 있을 때 분자들 낱개로 산산조각 흩어져서 존재하지 않으며 전기 쌍극자 모멘트 사이의 힘에 의해 결합되어 거대한 덩어리를 이룬다.
소금의 경우에는 조금 다르다. 화학을 모르는 사람들도 소금이 NaCl이라는 것은 너무나도 잘 아는데, 소금은 소듐 이온(Na+)과 염화 이온(Cl-)이 교대로 나열되어 있는 형태를 가진다. 이들 이온은 전하를 띤 입자들이므로 이온 사이에는 쿨롱의 법칙(Coulomb's law)을 따르는 정전기적 인력(electrostatic force)이 작용하며, 이 힘 때문에 이온들은 서로 떨어진 채로 개별적으로 존재하는 것이 아니라 서로가 서로에게 붙잡혀 구속된 채 일정한 거리를 두며 배열되어 있으며 그 결과 거대한 NaCl 결정을 이루게 된다.
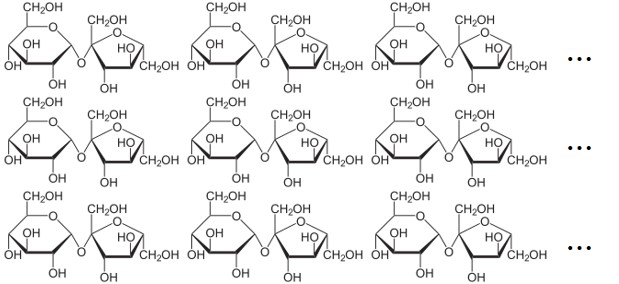
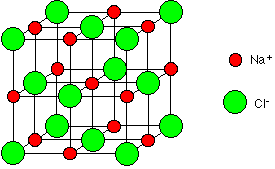
여기서 말하고 싶은 것은, 설탕이든 소금이든 구성 단위들 사이에는 전기적 인력이 작용하고 있는 상태로 자신들끼리 모여 있기를 선호한다는 것이다.
그렇다면 용매인 물은? 액체 상태인 물은 물 분자들이 서로 약하게 상호 작용하고 있는 상태인데 물 분자가 극성 분자이기 때문에 물 분자 사이에는 앞에서 언급한 전기 쌍극자 모멘트 사이의 전기력이 작용하지만 물은 굉장히 특별한 수소 결합(hydrogen bond)이라는 것을 하고 있다. 수소 원자가 전기 음성도(電氣陰性度, electronegativity)가 높은 다른 원자들 ㅡ 이를테면, 플루오린(F), 산소(O), 질소(N) ㅡ 와 결합되어 있는 분자의 경우 분자들 사이에는 수소 결합이 존재할 수 있는데, 이 수소 결합의 세기가 예상 외로 센 편이다. 이런 이유로 비교적 작은 분자량인 물의 끓는점이 비교적 높을 수 있는 것이다.
그러니까 정리해서 말하자면, 용질이든 용매든 서로 만나기 전에는 자기들끼리 서로 전기적 인력을 주고받으며 끼리끼리 사이좋게 지내고 있었다는 뜻이다. 여기서 한 가지 반드시 언급해줘야 하는 것은, 인력을 서로 주고받는 경우에는 전기 퍼텐셜 에너지(electric potential energy)가 음의 값이 되는데, 이는 서로 아무 힘을 주고받지 않고 멀리 떨어져 있을 때보다 비교적 안정적인 상태임을 나타내며 절댓값이 커질수록 안정한 정도는 더욱 커지게 된다. 뭐랄까, 서로 좋아하는 정도가 크다면 딱 달라붙어 있을 때가 안정한 것처럼? 자, 이제 용질을 용매에 넣어주게 되면 무슨 일이 발생하나?
먼저 설탕을 물에 넣어주자. 수크로스 분자 구조를 자세히 보면 얘네들도 산소 원자에 결합된 수소가 무척 많으므로 분자와 수소 결합을 형성할 수 있다. 그런데 수크로스 분자끼리는 원래 전기 쌍극자 모멘트에 의한 정전기적 인력을 주고받는 상태였다, 즉 이미 서로 짝이 있었던 상태였단 말이다. 그런데 어떻게 오랫동안 생사고락을 함께 했던 인연을 그리도 쉽게 끊어 버리고 물 분자와 새롭게 결합을 형성할 수 있단 말인가? 이 새집 살림의 근간에는 분자간 인력의 크기가 존재한다. 수크로스 분자 사이의 인력보다 수크로스-물 분자 사이의 인력이 수소 결합 때문에 훨씬 더 컸던 것이다. 인력이 크다는 것은 훨씬 퍼텐셜 에너지가 낮아진다는 것이고 다시 말하자면 더 안정하다는 것이다. 물 분자와 상호작용하는 것이 훨씬 에너지 면에서 이득이고 더욱 안정해질 수 있는 길인데 구태여 수크로스 분자들이 의리를 지키며 자기들끼리 뭉쳐있을 이유가 없다.4 이렇듯 분자들은 굉장히 에너지 계산적이며 냉정하다! 그 결과 수크로스 분자들은 서서히 물 분자들과 상호작용하면서 자기들 사이의 집합을 해체시키며 그 결과 설탕 덩어리는 차츰 수크로스 분자 수준으로 죄다 쪼개져서 물 분자들과 혼합된다.5
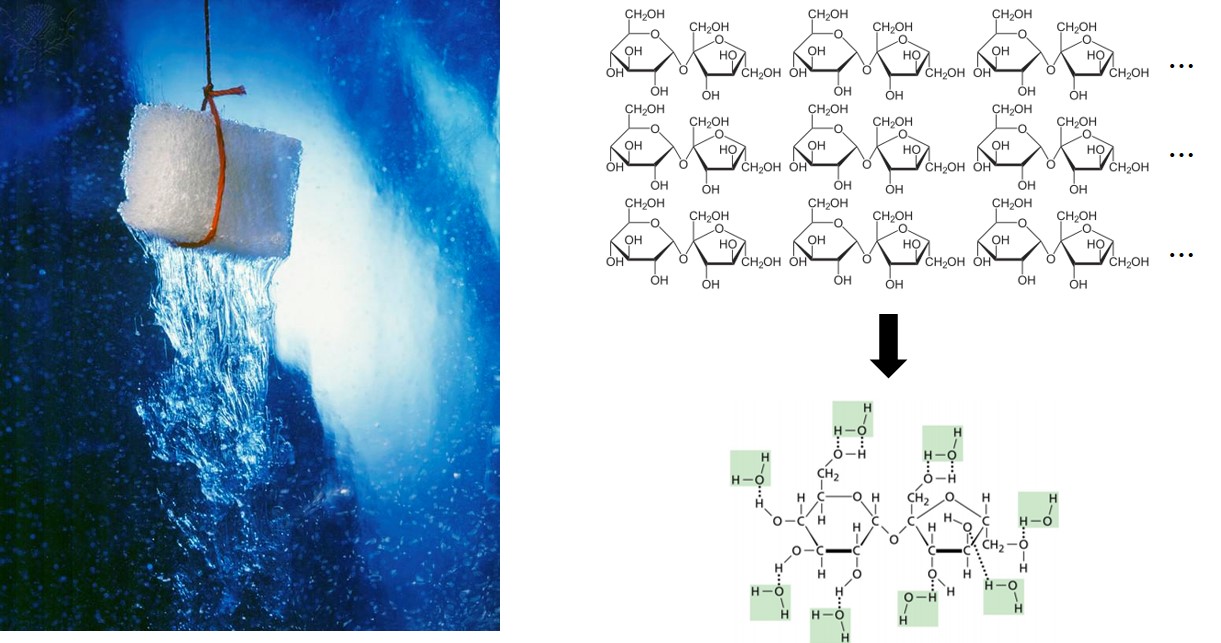
이젠 소금을 물에 넣어주자. 소금은 분자 형태가 아니라 이온 결정 상태이므로 설탕이 녹을 때와는 다른 설명이 필요하다. 설탕을 용해시킬 때의 논리를 그대로 적용한다면, 소금을 구성하는 이온들 사이의 힘보다 이온-물 분자 사이의 힘이 훨씬 커야 한다. 그래야 이온들 사이의 정전기적 인력을 끊어내고 물 분자 사이들에 퍼져나갈 수 있기 떄문이다. 사실 물 분자는 이와 같은 이온 결정 물질들을 낱낱이 해체시키는 데 아주 특출한 재능을 가진 용매인데, 그 비결은 바로 용매화(solvation)에 있다. 하나의 이온은 구조적 특성상 여러 개의 물 분자들과 동시에 상호작용할 수 있게 되는데, 그렇게 되면 주고 받는 인력이 곱절이 될 것이고 그에 따라 전기 퍼텐셜 에너지는 급격히 낮아져서 훨씬 안정한 상태가 될 것이다.6 따라서 소듐 이온과 염화 이온들은 각자 여러 물 분자들에 의해 둘러 싸인 형태가 되어 소금 결정으로부터 이탈하게 되고 그 결과 소금이 용해되는 것이다.
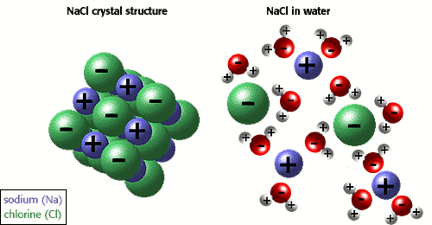
이렇듯 용질-용질 힘과 용매-용매 힘보다 용질-용매 힘이 더욱 크면 에너지 측면에서 더 안정해지기 때문에 용해 과정이 일어나게 되며, 그 결과 용질은 분자 혹은 이온 상태로 쪼개져 용매에 퍼지게 된다.
만일 섞여 들어가는 물질의 크기가 분자보다는 큰 덩어리이지만 1 μm (1,000,000 분의 1 m)보다 작은 수준이라면 이것은 용해가 아닌 분산 과정에 해당하며 이러한 물질을 분산질(分散質)이라고 한다.8 그렇다면 물질 B는 당연히 분산매(分散媒)라고 부를 수 있으며 이렇게 만들어진 것은 분산액(分散液, dispersion)이라고 부를 수 있겠다. 이 분산액은 꽤 오랜 시간동안 균일한 혼합물을 유지하지만 용액만큼은 아니므로 굉장히 오랜 시간이 지나면 상분리가 일어나는 분산액도 있다. 그것은 분산질과 분산매 사이의 상호 작용에 따라 다른데, 대체로 분산질의 크기가 커지면 커질수록 분산액의 안정성이 떨어지게 된다.9
만일 분산질의 크기가 1 μm 보다도 다소 큰 경우에는 어떠한 경우에라도 불균일한 혼합물이 형성되며 단시간 동안은 물질 A가 물질 B에 연속적으로 분포하는 것처럼 보이지만 시간이 지나면 상분리가 반드시 일어나게 되는데 이와 같은 불균일한 혼합물을 현탁액(懸濁液, suspension)이라고 부른다. 현탁액은 분산질의 크기가 큰 분산액이라고 생각하면 되며 현탁액은 분산액의 부분집합이라고 이해하면 되겠다. 한편, 분산액이나 현탁액이란 한자어 표현에 따르면 분산매는 꼭 액체여야만 할것 같지만, 이미 앞서 용액의 예에서 봤듯이 분산액/현탁액의 분산매는 기체일수도, 액체일수도, 그리고 고체일 수도 있다!
이 분산액은 용액과 굉장히 다른 성질들을 가지고 있는데, 가장 특징적인 차이는 바로 분산질들이 빛을 산란시킨다는 것이다. 분산질의 크기는 대체로 가시광선(可視光線)의 파장보다도 훨씬 큰 입자들이라서 가시광선의 빛을 모두 사방팔방으로 흩뜨려버린다. 그 결과 분산액은 용액과는 달리 불투명하며, 분산액을 통과하는 빛의 경우 그 경로가 눈에 선하게 보이게 된다. 그리고 이렇게 빛의 경로가 보이는 현상은 19세기 물리학자인 존 틴들(John Tyndall)의 이름을 따서 틴들 현상(Tyndall Effect)이라고 부른다. 그러니까 원래 개별적인 물질 자체는 투명한데 섞어놓으니 불투명해졌다면 그것은 분산액일 가능성이 굉장히 높고, 분산질의 크기가 특별히 크다면 그것은 현탁액이 될 것이다. 이제 분산액의 종류들을 하나하나씩 분석하면서 그 불투명성에 대해 이야기해보자.

자, 분산매가 기체인 경우를 생각해보자. 그렇다면 분산질이 기체, 액체, 고체인 경우가 있겠지? 하지만 애석하게도 기체 분자의 경우 기체의 정의 자체가 분자간 인력이 굉장히 낮아 분자 수준에서 생각하기에는 굉장히 멀리 떨어져 존재하는 분자들이기 때문에 기체 분자끼리는 무조건 분자 단위에서 자유롭게 섞이게 되므로 기체(분산질)-기체(분산매) 분산액이란 존재할 수가 없다.
반면 액체-기체 분산액은 흔히 볼 수 있는데, 바로 여름마다 모기를 쫓기 위해 뿌리는 살충제가 그것이다. 살충제 성분 중 하나인 다이에틸톨루아미드(diethyltoluamide)는 어는점이 -33도라서 상온에서는 액체로 존재한다. 그러면 모기를 잡기 위해 저 액체를 분무기로 뿌려야할텐데(!) 이런 활용 방법은 굉장히 비효율적이고 사용상 여러 문제점이 있다. 그래서 사람들이 개발한 것이 고압의 LPG 가스에 실어서 분산시킨 채 분사시키자는 것이었고, 그 결과 우리가 현재 흔히 쓰는 형태의 살충제가 등장하게 된 것이다. 살충제를 뿌리게 되면 흰 연기가 나오는 것같이 보이는데, 기체 분산매에 섞인 액체 분산질의 크기가 가시광선을 산란시키기에 충분한 크기라서 순간적으로 우리 눈에 그렇게 보이는 것이다.
고체-기체 분산액은 대한민국에서 봄마다 자주 볼 수 있다. 바로 미세먼지, 황사(黃沙), 연무(煙霧)가 그것이다. 이들 입자의 크기는 수~수십 μm 이며 대기라는 분산매에 퍼져 있는 아주 유해한 현탁액이다.10 이런 유해한 현탁액이 불투명하다는 것은 굳이 설명하지 않아도 불편하게 머릿속에서 그려질 것이다. (사실 이런 현탁액을 코로 늘 들이마셔야 한다는 사실이 굉장히 슬픈 일이다.)

순서를 바꾸어 분산매가 고체인 경우를 이야기해보자. 기체 분산질이 고체에 분산되어 있는 대표적인 경우는 바로 스티로폼이다. 폴리스타이렌(polystyrene)은 고분자화학 및 공업에서 굉장히 널리 사용되는 아주 기본적인 고분자 중 하나인데, 포장 및 단열재로 전세계에서 가장 많이 사용되는 고분자 제품 중 하나이다. 스티로폼 대부분은 공기가 차지하며 실제로 현미경으로 관찰해보면 굉장히 작은 공기거품들이 아주 얇은 폴리스타이렌 방울 사이에 갇혀 있는 형태이다. 폴리스타이렌은 결정성으로 제조되지 않는 경우 원래 투명하지만, 공기 거품들의 존재로 인해 스티로폼은 빛을 모두 산란시키며 그 결과 하얗고 불투명한 외양을 가지게 되었다.
액체-고체 분산액의 대표적인 경우는 독일에서 개발된 하리보(Haribo) 젤리 곰 과자가 될 것이다. 젤리는 대개 돼지껍데기에서 얻은 젤라틴(gelatin)이라는 단백질을 이용해 만드는데, 젤라틴은 물에 서서히 녹은 뒤 식으면서 굳어진다. 그런데 여기서 굳는다는 게 단순하게 고체가 된다는 그런 의미가 아니다. 젤라틴은 서로 결합되면서 3차원 구조를 만드는데 이 때 녹이는 데 사용된 물이 그 구조 안에 포함된 채 그대로 갇혀버리는 거라고 생각하면 된다.11

한편 고체-고체 분산액의 가장 대표적인 형태는 주변에서 굴러다니는 돌들이다. 대체로 주변에서 볼 수 있는 돌들은 한가지 단일한 화학 성분만으로 구성된 것이 아나며 여러 종류의 무기 광물들이 혼합된 형태를 취한다.
이제 분산매가 액체인 경우를 생각해보자. 먼저 분산질이 기체인 경우는 거품이 대표적이다. 물리학적 고찰에 따르면 거품의 크기는 액체가 거품에 가하는 압력과 거품의 기하학적 모양에 따른 곡률(curvature), 그리고 표면 장력에 의해 결정된다. 거품의 탄산 음료 내의 기포만큼이나 크기가 어느 정도 크다면 우리가 눈으로 투명한 액체 내에 생겨난 거품 하나하나를 개별적으로 관찰할 수 있지만, 거품 크기가 작아지게 되면 액체 자체는 아주 뿌옇게 되며 우리는 단지 표면에 드러난 거품만을 볼 수 있을 것이다. 이 때 거품이 마구 생겨난 액체가 뿌옇게 되는 이유는 거품이 빛을 산란시켜버리기 때문이다. 즉, 거품이 분산질인 일종의 현탁액을 우리가 보는 것이다. 거품의 크기가 극단적으로 작아진 채로 액체에 섞여 있는 대표적인 경우가 바로 크림이다.
액체-액체 분산액은 너무나도 흔하다. 서로 잘 안 섞이는(immiscible) 두 액체를 마구 섞어 일시적으로 혼합된 것만 같은 상태로 만들어 놓으면 그것이 액체-액체 분산액인데, 이 때 '일시적인 혼합 상태'를 유지하기 위해 첨가되는 것이 바로 유화제(乳化劑, emulsifier)이다. 여기서 눈치 빠른 독자라면 알아챘을 것이지만 유화제의 존재로 인해 형성된 액체-액체 분산액을 에멀전(emulsion)이라고 부르는데, 피부에 바르는 온갖 종류의 로션이 거의 이 에멀전의 영역에 속한다. 특별히 마요네즈는 아주 대표적인 액체-액체 현탁액인데 기름과 식초를 뒤섞은 것으로 유화제로 달걀이 쓰인다. 기름의 비율이 75%의 달하지만 이 기름은 잘게 부수어져서(?) 물과 섞이는 식초에 분산되어 있는데, 이 때 기름 방울들에 의해 빛이 산란되므로 기름이나 식초나 투명함에도 불구하고 이들을 섞어 만든 마요네즈는 허옇게 불투명한 존재가 되는 것이다.
그렇다면 대망의 마지막, 고체-액체 분산액은? 물에 안 녹는 진흙을 물에 넣고 흔들어 만든 불투명한 흙탕물 혹은 뻘물은 분산액의 완벽한 예이다. 의외로 고체-액체 분산액은 우리 몸에서도 찾아볼 수 있는데 바로 피가 그것이다. 피의 절반 이상은 혈장이라고 불리는 액체로 구성되어 있지만 그 나머지는 모두 일정 크기 이상의 세포들 ― 적혈구, 백혈구, 혈소판 등 ― 이며 이 때문에 피는 투명한 빨간색이 아니라 불투명한 빨간 색인 것이다.

그런데 이 고체-액체 분산액이 액체를 흡수하는 물질 표면 위에 떨어졌을 때를 생각해보자. 예를 들어 흰 옷을 입고 갯벌 가운데서 뛰어다녔다면 당사자는 굉장히 즐거웠겠지만 이걸 본 어머니는 크게 야단을 치실 것이다. 흰 옷 군데군데 뻘물이 들어 지저분한 색깔로 더러워졌기 때문일 것이다. 또 다른 예로 책장을 넘기다가 종이에 손이 베었을 때를 생각해보자. 종이 위에 피가 떨어지면 그 부분은 빨갛게 젖어들게 되는데 시간이 지나면 적갈색의 피 얼룩만 남게 된다. 즉, 분산매인 액체는 시간이 지나면서 증발해 버리지만 분산질인 고체 입자는 물질 표면 위에 달라붙어 물질을 염색(染色)시키는 것이다.
이쯤 되면 독자들은 눈치챘겠지만 길게 돌고 돌아 이제서야 물감에 대한 정의를 확실하게 내릴 수 있게 되었다. 물감을 화학적으로 분석하면 바로 고체-액체 분산액(정확히는 현탁액)이며 고체 분산질은 앞에서 언급한 현색제, 그리고 액체 분산매는 바로 전색제에 해당한다. 이미 소개한대로 물감의 현색제, 즉 고체 분산질은 돌가루인 안료인데, 이 돌가루의 크기는 수십 μm 이하의 작은 입자들이다. 바로 이런 이유로 물감을 풀어놓은 물은 불투명한 것이다. 다시한 번 힘주어 얘기하지만 우리가 초등학교 때 늘 사용해 왔던 수채 물감은 물에 결코 녹는 것이 아니었고 다만 '분산되는' 것이었다. 이제 독자들은 아래 영상을 봤을 때 물감이 곱게 빻은 돌가루로부터 만들어진다는 것에 큰 충격을 받지 않을 것이 분명하다.
이번 편을 통해 물감이 안료가 분산되어 있는 현탁액이라는 것을 확실히 이해하게 되었을 것이다. 이제는 현색제가 아닌 전색제로 관심을 돌려보자. 색깔을 내는 것은 현색제의 역할이라면 이 현색제를 평면 위에 전달해 주어 색깔이 고착될 수 있도록 해 주는 것이 전색제의 역할이다. 다음 편에서는 전색제의 역할과 발전을 물감의 역사와 함께 짚어볼 것이며 이를 위해 우선 타임머신을 타고 구석기 시대로 돌아가자.
▼[다음글] 2. 물감의 역사 (History of Paints)
 |
이 저작물은 크리에이티브 커먼즈 저작자표시-비영리-동일조건변경허락 4.0 국제 라이선스에 따라 이용할 수 있습니다. |